Резюме
Цель: Оценка действия in vitro препарата спрей Эпиген Интим 0,1% на бактериальные пленки, сформированные вагинальными микроорганизмами.
Материалы и методы.
Исследовано 72 клинических изолята чистых культур микроорганизмов, выделенных из вагинального биотопа: G.vaginalis (3 штамма), E.faecalis (9 штаммов), E.coli (18 штаммов), K.pneumoniae (15 штаммов), K.aerogenes (3 штамма), L.crispatus (3 штамма), S.pyogenes (3 штамма), A.baumanii (3 штамма), S.aureus (3 штамм), C.albicans (3 штамма), E.faecium (3 штамма), S.agalactiae (3 штамма), L.acidophilus (3 штамма).
Для культивирования, хранения и дальнейшего исследования использовали плотные и жидкие селективные питательные среды. Идентификацию микроорганизмов проводили методом латекс-агглютинации и с использованием MALDI-TOF масс-спектрометрии (Bruker Microflex). Способность к образованию биопленок оценивали по модифицированному протоколу Christensen с соавт. (1985).
Для оценки действия на сформированные бактериальные пленки использовали спрей Эпиген Интим 0,1%, содержащий активированную глицирризиновую кислоту (0,1 г на 100 мл).
Результаты. Из 72 клинических изолятов вагинальных микроорганизмов 38 показали способность образовывать бактериальные пленки (G.vaginalis, K.pneumoniae, E.coli, E.faecium). Тестируемые штаммы L.crispatus, L.acidophilus C.albicans, S.agalactiae, S.pyogenes и другие (34 штамма из 72) биопленки не образовывали. Таким образом, 53% микроорганизмов вагинального биотопа оказались способными образовывать биопленки. Именно эти штаммы микроорганизмов были включены в исследование.
Препарат спрей Эпиген Интим проявил высокую эффективность в отношении 34 из 38 штаммов микроорганизмов, образующих биопленки, что составило 89.48%. В четырех случаях разрушающего действия на биопленки не было выявлено (в отношении двух штаммов K.pneumoniae и штаммов E.coli и E.faecalis)
Заключение. Препарат спрей Эпиген Интим 0,1%, содержащий в своем составе активированную глицирризиновую кислоту, оказывает разрушающее действие на биопленки, образованные вагинальными микроорганизмами, такими как Gardnerella vaginalis, K.pneumoniae, E.coli, E.faecium с эффективностью in vitro 89,48%.
Введение
Бактерии, продуцирующие биопленки, являются серьезной проблемой во всех областях медицины во всем мире. Образование устойчивых бактериальных, грибковых или смешанных ассоциаций и окружающего их органического матрикса (биопленок) представляет собой универсальный механизм формирования резистентности микроорганизмов к различным антимикробным препаратам. Иными словами, биопленки представляют собой структурированный консорциум бактериальных и/или грибковых клеток, окруженных полимерным матриксом собственного производства.1 Биопленки на слизистой влагалища блокируют воспалительный ответ женского организма, снижают активность иммуноцитов, позволяя бактериям достигать высоких концентраций. Нарушение экосистемы влагалища у женщин репродуктивного возраста является одной из наиболее актуальных проблем в акушерско-гинекологической практике.2
Часто заболевание не ограничивается только нижними отделами половых путей. Восходящая инфекция приводит к развитию воспалительных заболеваний шейки матки (цервицит), а также полости матки (эндометрит) и ее придатков (сальпингоофорит). У пациенток с вагинальными инфекциями значительно повышена частота инфекционных осложнений после выполнения гинекологических манипуляций (аборт, гистероскопия, лапароскопия). Неудачные попытки ЭКО наблюдаются чаще у женщин с сопутствующим бактериальным вагинозом (БВ).3
Инфекции, вызванные штаммами микроорганизмов, способных образовывать пленки, плохо поддаются лечению антимикробными препаратами и часто рецидивируют, несмотря на защитные механизмы макроорганизма. Состав биопленок может быть монобактериальным и смешанным. Широкий спектр молекулярных механизмов способствует высокой степени сопротивляемости, характерной для биопленочных сообществ. Эти механизмы включают, среди прочего, взаимодействие противомикробных препаратов с компонентами матрикса биопленок, снижение скорости роста и различные действия специфических генетических детерминант устойчивости и толерантности к препаратам. По отдельности каждый из этих механизмов лишь частично объясняет повышенную резистентность к противомикробным препаратам, наблюдаемую в биопленках. Однако, действуя согласованно, эти защитные механизмы помогают обеспечить выживание микробных клеток в составе биопленки даже перед лицом самых агрессивных схем антимикробного лечения.4
Поэтому проводится поиск альтернативных препаратов, которые могут использоваться в качестве дополнительных средств в составе терапии биопленочных инфекций. Одним из таких средств может рассматриваться экстракт корня солодки. Применение корня солодки в качестве лечебного средства известно с давних времен. Например, в Кодексе Хаммурапи (2100 г. до н. э.) он упоминается, а китайская медицина в течение тысячи лет признает его средством улучшения качества жизни.
В корневище и корнях солодки (Glycyrrhiza glabra) содержится тритерпеноидные сапонины (4–20%). Важным сапонином корня солодки является водорастворимая молекула – глицирризин, соли глицирризиновой кислоты (глицирризиновая кислота также известна как глицирретиновая, гликозидная кислота, 18-β-глицирретиновая кислота и гликозид глицирретиновой кислоты).5
Глицирризиновая кислота, выделенная из корней солодки, является основным биоактивным ингредиентом, обладающим широким спектром биологической активности, включая противовоспалительное, противовирусное, противоязвенное, противоопухолевое и гепатопротекторное действие. Активированная глицирризиновая кислота является действующим веществом препарата спрей Эпиген Интим, 0,1%.
Целью исследования является оценка действия препарата спрей Эпиген Интим 0,1% на бактериальные пленки, сформированные вагинальными микроорганизмами in vitro.
Материалы и методы. В исследование включены 72 клинических штамма чистых культур микроорганизмов, выделенных из вагинального биотопа: G.vaginalis (3 штамма), E.faecalis (9 штаммов), E.coli (18 штаммов), K.pneumoniae (15 штаммов), K.aerogenes (3 штамма), L.crispatus (3 штамма), S.pyogenes (3 штамма), A.baumanii (3 штамма), S.aureus (3 штамм), C.albicans (3 штамма), E.faecium (3 штамма), S.agalactiae (3 штамма), L.acidophilus (3 штамма).
Для культивирования, хранения и дальнейшего исследования использовали плотные и жидкие питательные среды: кровяной агар с 5% дефибринированной крови (КА), среда Сабуро (агар и бульон), Триптиказо-соевый агар (ТСА), Триптиказо-соевый бульон (ТСБ), Триптиказо-соевый бульон с 10% глицерина (ТСБ-Г), Сердечно-мозговой бульон (СМБ), агар Мюллера-Хинтона (МХА) простой и с добавлением 5% дефибринированной крови. Идентификация микроорганизмов проводилась серологическими методами (реакция латекс-агглютинации) и методом MALDI-TOF спектрометрии на масс-спектрометре Bruker Microflex (Германия).
Способность к образованию биопленок была оценена по модифицированному протоколу Christensen с соавт.6
В зависимости от отношения оптической плотности (ОП) контроля к ОП образца штаммы микроорганизмов были разделены на 4 категории:
1. Штаммы, не образующие биопленку, – ОП образца на уровне оптической плотности контроля;
2. Штаммы, слабо образующие биопленку (1+), – ОП образца превышала оптическую плотность контроля не более чем в 2 раза;
3. Штаммы, умеренно образующие биопленку (2+), – ОП образца превышала оптическую плотность контроля в 2-4 раза;
4. Штаммы, образующие выраженную биопленку (3+), – ОП образца превышала оптическую плотность контроля более чем в 4 раза.
В исследовании использовали спрей Эпиген Интим 0,1% (Производство по заказу «Хемигруп Франс С.А.», Франция («Б. Браун Медикал С.А.», Хаен, Испания) для ООО «Инвар®», Россия). Действующее вещество препарата Эпиген Интим — активированная глицирризиновая кислота (0,1 г на 100 мл). Вспомогательные вещества — яблочная кислота, фумаровая кислота, аскорбиновая кислота, фолиевая кислота, пропиленгликоль, твин-80 (полисорбат-80), вода очищенная.
Результаты
Исследование основано на количественном определении биопленок в полистироловых плоскодонных планшетах по модифицированному методу Christensen et al (1985г).6
Чистую суточную культуру каждого штамма микроорганизмов, выращенных на плотной питательной среде, помещали в лунки 24-луночного полистиролового планшета с 450 мкл питательной среды (ТСБ) с 1% глюкозы. Лунки отрицательного контроля (К-) содержали 500 мкл ТСБ с 1% глюкозы и не содержали микроорганизмов. После инкубации в течение 48 часов лунки опорожняли, трехкратно промывали фосфатно-солевым буфером (PSB; pH 7,2) и окрашивали 2% генцианвиолетом. Краситель элюировали 96% этанолом и измеряли оптическую плотность (ОП) раствора в каждой лунке при 570 нм с помощью спектрофотометра. Пороговое значение (ПЗ) определяли как три стандартных отклонения выше средней оптической плотности отрицательного контроля. Окончательное значение ОП выражалось как среднее значение ОП штамма, уменьшенное на величину порогового значения (рассчитывается для каждого микроорганизма отдельно). Если получено отрицательное значение, оно представляется как ноль, любое положительное значение указывает на образование биопленки.
Тестируемые штаммы L.crispatus, L.acidophilus C.albicans, S.agalactiae, S.pyogenes (34 штамма из 72) биопленки не образовывали. Таким образом, в исследование по действию препарата спрей Эпиген Интим 0,1% на бактериальные пленки были включены 38 штаммов биопленкообразующих микроорганизмов, что составило 53%.
Результаты измерений ОП и их интерпретация по исследованию воздействия препарата спрей Эпиген Интим 0,1% на бактериальные пленки, сформированные разными микроорганизмами, представлены в таблице.
Действие препарата спрей Эпиген Интим 0,1% на бактериальные пленки, сформированные разными микроорганизмами
| № штамма | Название м/о | ОП биопленки | БП | ОП биопленки после действия Эпигена | Коэффициент изменения ОП после действия Эпигена | Действие Эпигена на БП |
| 1. | A.baumanii | 0.346 | 1+ | 0.001 | 346 | + |
| 2. | A.baumanii | 0.249 | 1+ | 0.001 | 249 | + |
| 3. | A.baumanii | 0.238 | 1+ | 0.001 | 238 | + |
| 4. | E.coli | 0.875 | 2+ | 0.892 | 0.98 | - |
| 5. | E.coli | 0.743 | 2+ | 0,001 | 743 | + |
| 6. | E.coli | 0.658 | 2+ | 0,001 | 658 | + |
| 7. | E.coli | 0.519 | 1+ | 0.001 | 519 | + |
| 8. | E.coli | 0.516 | 1+ | 0.001 | 516 | + |
| 9. | E.coli | 0.514 | 1+ | 0.001 | 514 | + |
| 10. | E.coli | 1.269 | 3+ | 0.347 | 3.66 | + |
| 11. | E.coli | 1.125 | 3+ | 0.219 | 5.14 | + |
| 12. | E.coli | 1.084 | 3+ | 0.241 | 4.50 | + |
| 13. | E.faecalis | 0.522 | 2+ | 0.001 | 522 | + |
| 14. | E.faecalis | 0.488 | 2+ | 0.001 | 488 | + |
| 15. | E.faecalis | 0.476 | 2+ | 0.001 | 476 | + |
| 16. | E.faecalis | 0.468 | 2+ | 0.001 | 468 | + |
| 17. | E.faecalis | 0.284 | 1+ | 0.198 | 1.43 | - |
| 18. | G.vaginalis | 1.587 | 3+ | 0.401 | 3.96 | + |
| 19. | G.vaginalis | 1.489 | 3+ | 0.345 | 4.32 | + |
| 20. | G.vaginalis | 1.283 | 3+ | 0.241 | 5.32 | + |
| 21. | K.pneumoniae | 0.974 | 2+ | 0.749 | 1,3 | - |
| 22. | K.pneumoniae | 0.915 | 3+ | 0.214 | 4.28 | + |
| 23. | K.pneumoniae | 1.562 | 3+ | 0.389 | 4.02 | + |
| 24. | K.pneumoniae | 1.559 | 3+ | 0.377 | 4.14 | + |
| 25. | K.pneumoniae | 1.548 | 3+ | 0.341 | 4.54 | + |
| 26. | K.pneumoniae | 1.539 | 3+ | 0.347 | 4.44 | + |
| 27. | K.pneumoniae | 1.291 | 3+ | 0.134 | 9.63 | + |
| 28. | K.pneumoniae | 1.195 | 3+ | 0.156 | 7.67 | + |
| 29. | K.pneumoniae | 2.157 | 3+ | 0.569 | 3.79 | + |
| 30. | K.pneumoniae | 1.122 | 2+ | 0.134 | 8.37 | + |
| 31. | K.pneumoniae | 1.095 | 3+ | 0.256 | 4.33 | + |
| 32. | K.pneumoniae | 1.074 | 2+ | 0.758 | 1.40 | - |
| 33. | K.pneumoniae | 2.052 | 3+ | 0.469 | 4.47 | + |
| 34. | K.pneumoniae | 2.048 | 3+ | 0.459 | 4.46 | + |
| 35. | K.pneumoniae | 2.037 | 3+ | 0.478 | 4.65 | + |
| 36. | S.aureus | 0.514 | 1+ | 0.001 | 514 | + |
| 37. | S.aureus | 0.458 | 1+ | 0.001 | 458 | + |
| 38. | S.aureus | 0.367 | 1+ | 0.001 | 367 | + |
Примечание к таблице: ОП – оптическая плотность; БП – бактериальная пленка; + наличие биопленки и ее плотность (1+; 2+: 3+); Э 1,0 – оптическая плотность биопленки после воздействия препарата спрей Эпиген Интим 0,1%; коэффициент изменения ОП после действия препарата спрей Эпиген Интим 0,1% (отношение ОП биопленки к ОП после действия препарата спрей Эпиген Интим 0,1%); действие препарата спрей Эпиген Интим 0,1% на биопленки (+ да, - нет).
Как видно из данных, приведенных в таблице, из 38 клинических штаммов микроорганизмов высокая способность к образованию плотной биопленки (3+) была у 18. Это были все G.vaginalis (3 штамма), 12 штаммов K.pneumoniae, а также 3 штамма E.coli. Их ОП была в пределах 1,125 – 2,157, т.е. превышала ОП контроля более чем в 4 раза и была выше 0,8 оптических единиц (о.е). Среднее биопленкообразование (2+) было у 10 штаммов бактерий (3 штамма E.coli, 4 штамма E.faecalis и 3 штамма K.pneumoniae), т.к. ОП образца превышала оптическую плотность контроля в 2-4 раза, их ОП была в диапазоне от 0,4 до 0,8 о.е. Ряд штаммов микроорганизмов, их 10, такие как S.aureus, A.baumanii, E.coli, E.faecalis, обладали слабой способностью образовывать биопленки (1+). Их ОП была выше оптической плотности контроля не более чем в 2 раза и составляла 0,2 - 0,4 о.е.
Из 38 штаммов микроорганизмов, образующих биопленки, препарат спрей Эпиген Интим 0,1% оказал разрушающее действие на 34, что составило 89,48%. Здесь следует подчеркнуть, что снижение ОП биопленки более, чем в три раза (коэффициент изменения ПО после воздействия препаратом спрей Эпиген Интим 0,1% был более 3), указывает на разрушающее биопленки действие препарата. Для 34 штаммов коэффициент изменения ПО составил от 3,66 до 743. На биопленки, сформированные четырьмя штаммами микроорганизмов (два штамма K.pneumoniae, E.coli и E.faecalis), препарат спрей Эпиген Интим 0,1% не оказал разрушающего действия.
На рис. 1 представлена диаграмма, иллюстрирующая данные таблицы. Фиолетовая линия показывает ОП биопленочной культуры: чем выше ОП, тем более плотная биопленка образована. Синим цветом показана ОП культуры в биопленке после действия препарата спрей Эпиген Интим 0,1%. Чем больше расхождение красной и синей линий, тем более выраженное действие оказывает препарат спрей Эпиген Интим 0,1% на биопленки.
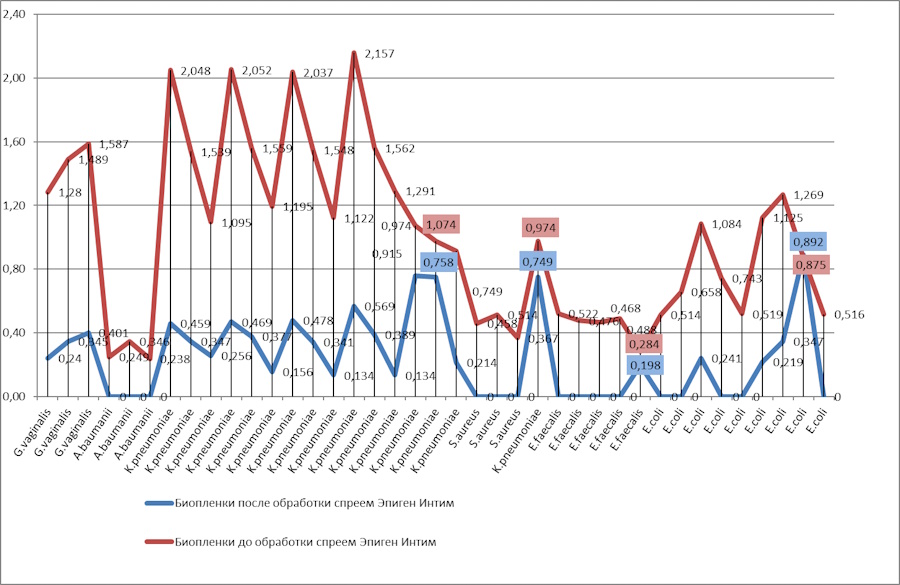
Рис. 1. Графическое изображение действия препарата спрей Эпиген Интим 0,1% на бактериальные пленки микроорганизмов.
Обсуждение
В настоящее время идет поиск новых препаратов с антимикробной и противобиопленочной активностью. Представлен обзор некоторых из последних отчетов о природных ингибиторах биопленок. Эти метаболиты могут использоваться в качестве мощных терапевтических средств для повышения эффективности антибиотиков против заболеваний, связанных с биопленками. Значительный антибиопленочный потенциал был обнаружен у фенольных соединений, полиацетиленов, терпеноидов, алкалоидов, лектинов и полипептидов. Конденсированные танины, особенно среди фенольных соединений, продемонстрировали антибиопленочную активность.7 Корень солодки содержит 20 тритерпеноидов и почти 300 флавоноидов. Наиболее важным веществом в этом отношении является глицирризиновая кислота (ГК). Исследования in vitro и in vivo показали, что ГК ингибирует репликацию ДНК или РНК некоторых вирусов, поражающих людей или животных.7,8 Предыдущие исследования показали, что 80% бактериальных инфекций и лекарственной устойчивости связаны с образованием бактериальных биопленок.9 Как показало исследование, ГК эффективно ингибируют образование биопленок S. аureus, в том числе MRSA, что способствует снижению риска лекарственной устойчивости.10 Механизмы ГК против MRSA в основном включают подавление генов вирулентности, ингибирование продукции α-гемолизина и образования биопленок.11,12,13 Гидрогели производных ГК первоначально прилипают к поверхности и проникают в бактерии, затем влияют на биосинтез и метаболизм аргинина, что в конечном итоге приводит к гибели бактерий.14,15 Однако детали механизмов требуют дальнейшего изучения.
Образованные биопленки монокультурой Enterococcus faecalis с кинетикой роста через 24 и 48 часов при обработке экстрактом солодки продемонстрировали снижение КОЕ/мл энтерококков, что было проверено методом подсчета жизнеспособных микроорганизмов, и скудность архитектуры биопленок по сравнению с контрольной группой.16 В нашем исследование эффективность разрушающего действия препарата Эпиген интим на биопленки оценивалось и регистрировалось по изменению ОП (в 3 и более раз). В биопленках, сформированных четырьмя из пяти изолятов E.faecalis ОП уменьшилось более чем в 400 раз.
Образование биопленки также является важной физиологической особенностью P. aeruginosa, которая позволяет ей выживать и сопротивляться даже в присутствии противомикробных агентов. Экстракт трав и ГК эффективны в воздействии на физиологические и биохимические параметры бактерий, которые включают проницаемость клеточных мембран и образование биопленок. Рост P. aeruginosa значительно подавлялся экстрактом корня солодки и его чистым соединением, глицирризиновой кислотой.17 Таким образом, ингибирование образования биопленки может способствовать уничтожению бактерий. Чтобы выяснить антибиопленочную активность, был проведен анализ образования биопленки на микротитровальной планшете и было обнаружено, что тестируемые образцы (ципрофлоксацин, экстракт корня солодки и глицирризиновая кислота) ингибировали образование биопленки в 65,06%–83,35% в диапазоне концентраций 50-200 мкг / мл. Ингибирующий эффект постепенно возрастал с увеличением концентрации препарата.17 ГК повреждала полисахариды структуры внеклеточного матрикса и белки системы кворум-сенсинга, препятствуя способности бактерий определять плотность популяции, а также продуцировать факторы вирулентности и подвижности микроорганизмов; она вызывает сапонификацию мембран бактериальных клеток, что нарушает стабильность биопленки и снижает экспрессию генов, ответственных за формирование биопленки.18
Образование биопленки микроорганизмами позволяет им выживать и избегать агрессивного воздействия окружающей среды, включая воздействие антимикробных химиопрепаратов в течение длительного времени. Следовательно, это может привести к сохранению тяжести заболевания, хронизации и рецидивированию инфекционного процесса. Несмотря на применение антибиотиков, поиск эффективных средств все еще продолжается. Сообщается, что среди альтернатив антибиотикам в качестве применимой стратегии можно использовать растительные экстракты и натуральные растительные продукты в качестве добавок, иммуностимуляторов для усиления неспецифического защитного механизма хозяина и ингибирования биопленкообразования.
Мы исследовали влияние активированной ГК на биопленки, созревающие в течение 48 часов, на поверхности полистиролового планшета, чтобы имитировать образование биопленок на поверхностях органов макроорганизма, в частности, на слизистой влагалища. Препарат подействовал на 34 из 38 штаммов микроорганизмов, образующих биопленки. Эффективность действия активированной ГК в составе препарата спрей Эпиген Интим 0,1% мы оценили в 89,47% Исключение составили два штамма K.pneumoniae и штаммы E.coli, и E.faecalis. Действие активированной ГК против микробной биопленки является штаммоспецифичным. Тестируемые нами штаммы дрожжеподобных грибов C.albicans биопленки не образовывали. Cуществует лишь несколько сообщений о влиянии соединений корня солодки на C. albicans. Эти исследования ограничивались влиянием экстракта корня солодки на рост C. albicans. Было обнаружено, что экстракт Glycyrrhiza glabra L. глабридин ингибирует рост C. albicans. Глицирризиновая кислота не проявляла никакого эффекта в концентрациях до 200 мкг/ мл.19
В ранее проведенном нами исследовании был показан эффективный опыт комбинированной терапии бактериального вагиноза. В данном исследовании мы применяли препарат спрей Эпиген Интим 0,1%, содержащий активированную глицирризиновую кислоту. Исследование было двойным слепым плацебо-контролируемым. Рассмотрение динамики изменения использованных в работе показателей позволяет констатировать благоприятное влияние спрея Эпиген Интим 0,1% в комплексном лечении БВ: в более короткий срок исчезает неприятный запах влагалищных выделений, жалобы пациенток на дискомфорт в области влагалища, быстрее снижаются значения рН влагалищных выделений и исчезают «ключевые» клетки, которые выявляются при микроскопическом исследовании вагинальных выделений. Микроскопическое и культуральное исследования выявляют значительное увеличение числа лактобацилл у женщин, которым проведено комбинированное лечение с использование препарата спрей Эпиген Интим 0,1% по сравнению с теми пациентками, которым заменен этот препарат на плацебо и с теми, которые получали только антибиотик.20
Поскольку одним из основных биопленкообразующих микроорганизмов, входящих в состав вагинального биотопа при БВ, является Gardnerella vaginalis, нами в настоящем исследовании было показано, что спрей Эпиген Интим разрушает биопленки, образованные этими микроорганизмами. Это необходимо учитывать при назначении препаратов для лечения БВ. Кроме того, нами показано действие препарата спрей Эпиген Интим 0,1% на биопленки, сформированные и другими микроорганизмами, возможными возбудителями аэробного (неспецифического) вагинита, такими как K.pneumoniae, E.coli, Efaecalis. Этот факт нужно учитывать при выборе препаратов для комплексной терапии аэробного вагинита.
В данном исследовании мы не обнаружили явления биопленкообразования лактобациллами и дрожжеподобными грибами. Это побуждает нас провести дальнейшие исследования.
Таким образом, препарат спрей Эпиген Интим 0,1% показал высокую эффективность в отношении исследованных нами микроорганизмов и может быть рекомендован для использования в комплексной терапии бактериального вагиноза и аэробного вагинита.
Заключение
Препарат спрей Эпиген интим 0,1%, содержащий в своем составе активированную глицирризиновую кислоту, оказывает эффективное разрушающее действие на биопленки, образованные разными микроорганизмами, такими как Gardnerella vaginalis, Klebsiella pneumoniae, Escherichia coli, Enterococcus faecalism. Эффективность действия на биопленки оценивается в 89.48%. Следует подчеркнуть, что снижение ОП биопленки более, чем в три раза указывает на разрушающее биопленки действие препарата. Для 34 изолятов микроорганизмов коэффициент изменения ОП после воздействия препаратом спрей Эпиген Интим 0,1% составил от 3,66 до 743.
Литература
- Hall-Stoodley L, Stoodley P, Kathju S, et al. Towards diagnostic guidelines for biofilm-associated infections. FEMS Immunol Med Microbiol. 2012;65:127-145. doi: 10.1111/j.1574-695X.2012.00968.x
- К.В. Шалепо, Т.Г. Михайленко, А.М. Савичева. Роль Бактериальных пленок в формировании хронических патологических процессов во влагалище и эндометрии. Journal of Obstetrics and Women’s Diseases. 2016;65(4):65-75 УДК: 618.145+618.15]-07 DOI: 10.17816/JOWD65465-75
- Wilson JD, Ralph SG, Rutherford AJ. Rates of bacterial vaginosis in women undergoing in vitro fertilisation for different types of infertility. BJOG. 2002;109:714-7. doi: 10.1111/j.1471-0528.2002.01297.x
- Hall CW, Mah TF. Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria.FEMS Microbiol Rev. 2017 May 1;41(3):276-301. doi: 10.1093/femsre/fux010.PMID: 28369412 Review.
- Andersen FA. Final report on the safety assessment of glycyrrhetinic acid potassium glycyrrhetinate disodium succinoyl glycyrrhetinate glyceryl glycyrrhetinate glycyrrhetinyl stearate stearyl glycyrrhetinate glycyrrhizic acid ammonium glycyrrhizate dipotassium glycyrrhizate disodium glycyrrhizate trisodium glycyrrhizate methyl glycyrrhizate and potassium glycyrrhizinate. Int J Toxicol. 2007;26((Suppl 2)):79–112.
- Christensen GD, Simpson WA, Younger JJ, et al. Adherence of coagulase-negative staphylococci to plastic tissue culture plates: A quantitative model for the adherence of staphylococci to medical devices. J Clin Microbiol. 1985;22(6):996–1006. doi:10.1128/jcm.22.6.996-1006.1985.
- К.В. Шалепо, Т.Г. Михайленко, А.М. Савичева. Роль Бактериальных пленок в формировании хронических патологических процессов во влагалище и эндометрии. Journal of Obstetrics and Women’s Diseases. 2016;65(4):65-75 УДК: 618.145+618.15]-07 DOI: 10.17816/JOWD65465-75
- Wilson JD, Ralph SG, Rutherford AJ. Rates of bacterial vaginosis in women undergoing in vitro fertilisation for different types of infertility. BJOG. 2002;109:714-7. doi: 10.1111/j.1471-0528.2002.01297.x
- Hall-Stoodley L, Stoodley P, Kathju S, et al. Towards diagnostic guidelines for biofilm-associated infections. FEMS Immunol Med Microbiol. 2012;65:127-145. doi: 10.1111/j.1574-695X.2012.00968.x
- Hall CW, Mah TF. Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria.FEMS Microbiol Rev. 2017 May 1;41(3):276-301. doi: 10.1093/femsre/fux010.PMID: 28369412 Review.
- Andersen FA. Final report on the safety assessment of glycyrrhetinic acid potassium glycyrrhetinate disodium succinoyl glycyrrhetinate glyceryl glycyrrhetinate glycyrrhetinyl stearate stearyl glycyrrhetinate glycyrrhizic acid ammonium glycyrrhizate dipotassium glycyrrhizate disodium glycyrrhizate trisodium glycyrrhizate methyl glycyrrhizate and potassium glycyrrhizinate. Int J Toxicol. 2007;26((Suppl 2)):79–112.
- García-Salazar G, Urbán-Morlán Z, Mendoza-Elvira S, Quintanar-Guerrero D, Mendoza S. Broad Antiviral Spectrum of Glycyrrhizic Acid for Human and Veterinary Medicine: Reality or Fiction?Intervirology. 2023;66(1):41-53. doi: 10.1159/000528198. Epub 2022 Dec 1.PMID: 36455522
- Baltina LA, Tasi YT, Huang SH, Lai HC, Baltina LA, Petrova SF, Yunusov MS, Lin CW.Glycyrrhizic acid derivatives as Dengue virus inhibitors. Bioorg Med Chem Lett. 2019 Oct 15;29(20):126645. doi: 10.1016/j.bmcl.2019.126645. Epub 2019 Aug 29.PMID: 31519375
- Ouyang J, Bu QY, Tao N, et al. A facile and general method for synthesis of antibiotic-free protein-based hydrogel: wound dressing for the eradication of drug-resistant bacteria and biofilms. Bioact Mater. 2022:18446–18458. doi: 10.1016/j.bioactmat.2022.03.033
- Fu X, Ni Y, Wang G, Nie R, Wang Y, Yao R, Yan D, Guo M, Li N.Synergistic and Long-Lasting Wound Dressings Promote Multidrug-Resistant Staphylococcus Aureus-Infected Wound Healing. Int J Nanomedicine. 2023 Aug 16;18:4663-4679. doi: 10.2147/IJN.S418671. eCollection 2023.PMID: 37605733
- Rohinishree YS, Negi PS. Effect of licorice extract on cell viability, biofilm formation and exotoxin production by Staphylococcus aureus. J Food Sci Tech Mys. 2016;53(2):1092–1100. doi: 10.1007/s13197-015-2131-6 [
- Mohammed EAH, Peng Y, Wang Z, Qiang X, Zhao Q. Synthesis, antiviral, and antibacterial activity of the glycyrrhizic acid and glycyrrhetinic acid derivatives. Russ J Bioorg Chem. 2022;48(5):906–918. doi: 10.1134/S1068162022050132
- Pastorino G, Cornara L, Soares S, Rodrigues F, Oliveira M. Liquorice (Glycyrrhiza glabra): a phytochemical and pharmacological review. Phytother Res. 2018;32(12):2323–2339. doi: 10.1002/ptr.6178
- Li Q, He Q, Xu M, et al. Food-grade emulsions and emulsion gels prepared by soy protein-pectin complex nanoparticles and glycyrrhizic acid nanofibrils. J Agric Food Chem. 2020;68(4):1051–1063. doi: 10.1021/acs.jafc.9b04957
- А.М. Савичева, Ю.Н. Менухова, Н.Е. Воробьева, В.В. Назарова, К.В. Шалепо, Н.Ю. Ширшова, М.А. Башмакова. Опыт комбинированной терапии у больных с бактериальным вагинозом. Российский вестник акушера-гинеколога. 2011. Т. 11. № 3.С.69-73

